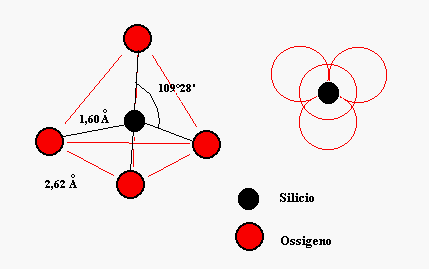
1) Elementi strutturali dei silicati
Parleremo dei vetri a base di silice anche se oggigiorno stanno assumendo sempre più importanza sistemi a base di non-ossidi ( fluoruri, calcogenuri ...). Alla base della struttura dei silicati cristallini troviamo il tetraedro [SiO4] (Fig.1)
Fig.1

l’atomo di silicio (in nero ) si trova al centro di un tetraedro ai cui vertici ci sono quattro atomi di ossigeno, se ipotizziamo gli atomi come sfere rigide a contatto l’una delle altre allora troviamo che l’angolo di legame ![]() è 109°28’ mentre le distanze
è 109°28’ mentre le distanze ![]() e
e ![]() sono rispettivamente di 1,60 Å e 2,62 Å.
sono rispettivamente di 1,60 Å e 2,62 Å.
L’origine di questo arrangiamento atomico nei silicati cristallini è da ricercarsi nella configurazione elettronica dell’atomo di silicio: ![]() . Quest’atomo possiede 4 elettroni nello strato o "shell" esterno; nello stato fondamentale due di questi sono accoppiati in un orbitale di tipo s ed altri due in un orbitale di tipo p.
. Quest’atomo possiede 4 elettroni nello strato o "shell" esterno; nello stato fondamentale due di questi sono accoppiati in un orbitale di tipo s ed altri due in un orbitale di tipo p.
Come si vede in figura 2 lo stato fondamentale è solo di poco più stabile dello stato che presenta i quattro elettroni spaiati in un orbitale ibrido sp3.
Fig.2
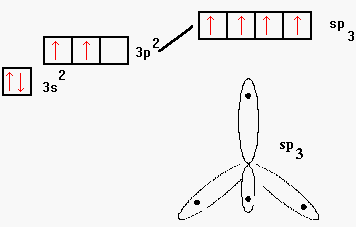
L’orbitale ibrido sp3 è caratterizzato da 4 lobi orientati lungo le congiungenti il centro con i vertici di un tetraedro, in ognuno dei lobi c’è la probabilità massima di trovare un elettrone del silicio. Quando l’atomo di silicio si combina con 4 atomi di ossigeno si forma l’elemento strutturale SiO44-.
Secondo Pauling la natura del legame Si-O è mista tra un legame polare puro un legame isovalente ed un legame doppio:
Fig.3
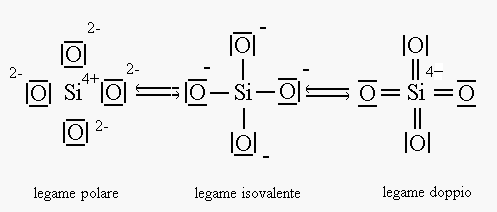
Calcoli teorici eseguiti da Pauling hanno confermato che le distanze interatomiche e gli angoli di legame osservati derivano da una "risonanza" di questi tre legami cioè il legame reale è risultato di un veloce passaggio da una forma all’altra. (distanza Si-O: osservata: 0,160 Å, calcolata 0,162 Å).
2) Formazione di silicati complessi
il tetraedro può dare origine a silicati complessi attraverso un processo di "polimerizzazione"; il meccanismo alla base di ciò sta nella saturazione degli "shell" elettronici degli atomi di ossigeno in modo da formare "ottetti" elettronici . questo si realizza in due modi:
2.1) neutralizzazione del complesso SiO4- con ioni metallici positivi
2.2) connessione dei tetraedri via "ponti ad ossigeno"
Fig.4
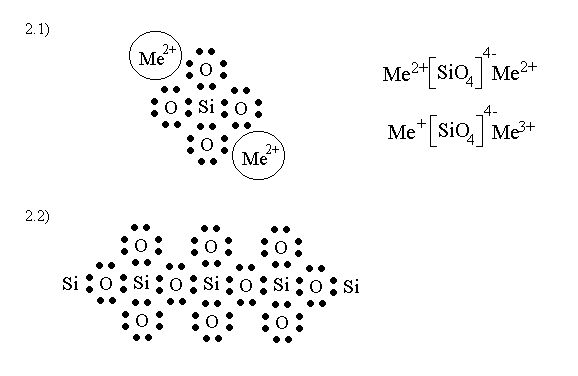
In questo modo si possono formare molecole giganti nelle quali i tetraedri finali vengono saturati da atomi metallici.
§
2.2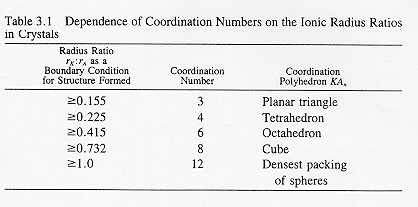
La coordinazione che un atomo può raggiungere quando si lega a degli anioni come ad esempio l’ossigeno è in funzione del rapporto tra i raggi ionici (Pauling) § 2.2: nel caso della silice ![]() si ha cioè una coordinazione tetraedrica. In figura § 2.3 vediamo come il
si ha cioè una coordinazione tetraedrica. In figura § 2.3 vediamo come il
tetraedro fondamentale si combina per formare silicati cristallini.
§
2.3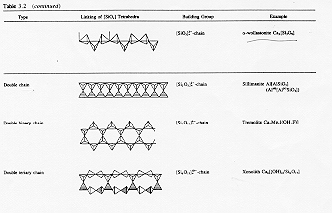
3) Ossidi vetro formatori
Possono formare in condizioni di raffreddamento "normali", ad esempio lasciati liberi di raffreddarsi in atmosfera, gli ossidi di quegli elementi che non sono così elettropositivi da dare origine a legami ionici (come il cloruro di sodio) né così elettronegativi da dare origine a legami prevalentemente covalenti e quindi a molecole come la CO2 ecc.
Fig 5.
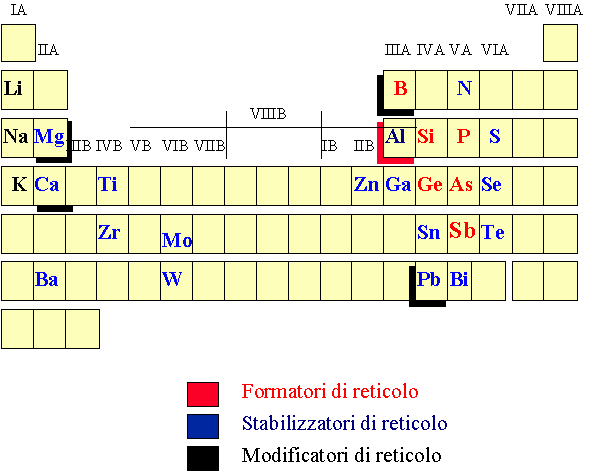
come si vede dalla figura 5 in rosso sono riportati i vetro-formatori veri e propri (As2O3 e Sb2O3 possono formare vetri se raffreddati rapidamente), in celeste sono riportati quegli elementi i cui ossidi da soli non possono formare vetri ma lo fanno in associazione con un ossido vetro-formatore essi sono anche chiamati "conditional glass formers" o stabilizzatori di reticolo. In nero infine sono riportati alcuni esempi di elementi molto elettropositivi e i cui ossidi vengono chiamati vetro-modificatori, la loro funzione è in genere quella di saturare con le proprie cariche positive l’eccesso di carica negativa dovuto ad esempio alla presenza in vetri silicatici di ossigeni non a ponte ( vedi 2.1 Fig.4). Le ombreggiature si riferiscono a comportamenti misti degli ossidi, nella figura vediamo ad esempio che l’ossido di alluminio che si comporta generalmente da vetro-stabilizzatore può in certe condizioni agire da vetro-formatore.
4) Modelli strutturali dello stato vetroso
4.1) Modello di Goldschmidt (1926)
Goldschmidt prese spunto per la sua teoria sullo stato vetroso dallo studio di sistemi semplici cristallini di formula generale: ![]() tentando di correlare l’abilità da parte di un ossido a formare un vetro con il rapporto tra i raggi ionici del catione e dell’anione: i vetro-formatori sono quegli ossidi per i quali il rapporto raggio cationico/raggio ionico è compreso tra 0,2 e 0,4. Abbiamo in effetti visto § 2.2 che il numero di coordinazione di un atomo è predetto dal rapporto con il raggio ionico degli atomi che lo circondano, secondo Goldschmidt la coordinazione e quindi la capacità di formare un vetro è guidata da ragioni di ingombro geometrico (atomi associati a sfere rigide che debbono mantenere il contatto l’una con l’altra). Secondo G. la configurazione tetraedrica è un prerequisito per la formazione di un vetro.
tentando di correlare l’abilità da parte di un ossido a formare un vetro con il rapporto tra i raggi ionici del catione e dell’anione: i vetro-formatori sono quegli ossidi per i quali il rapporto raggio cationico/raggio ionico è compreso tra 0,2 e 0,4. Abbiamo in effetti visto § 2.2 che il numero di coordinazione di un atomo è predetto dal rapporto con il raggio ionico degli atomi che lo circondano, secondo Goldschmidt la coordinazione e quindi la capacità di formare un vetro è guidata da ragioni di ingombro geometrico (atomi associati a sfere rigide che debbono mantenere il contatto l’una con l’altra). Secondo G. la configurazione tetraedrica è un prerequisito per la formazione di un vetro.
Questo modello si espone ad alcune critiche: innanzitutto come si è visto i calcoli di Pauling hanno portato alla conclusione che il legame interatomico almeno nei vetri silicatici è un legame misto e non ionico puro come sembra affermare Goldschmidt inoltre ci sono sostanze come ad esempio l’ossido di berillio fuso BeO che pur avendo 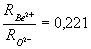 tuttavia non forma se raffreddato un vetro.
tuttavia non forma se raffreddato un vetro.
4.2) Modello di Zachariasen-Warren
Osservazioni condotte su numerosi ossidi formatori di vetro mostrano che le proprietà meccaniche, la densità ecc. della fase vetrosa sono simili a quelle possedute dal corrispettivo solido cristallino da questi fatti Zachariasen dedusse che una sostanza allo stato vetroso e cristallino dovesse avere distanze e forze interatomiche simili, anche nei vetri,dunque gli atomi dovevano arrangiarsi in un reticolo che si estende in modo continuo ed indefinito nelle tre dimensioni.
Indagini effettuate con la tecnica della diffrazione a raggi X su bassi angoli effettuate da Warren confermarono per i vetri una struttura non ordinata e tridimensionale nella quale le lunghezze e gli angoli di legame variavano in modo continuo entro un certo range (17 %).
Una struttura continua che possedeva un certo grado di disordine spiegava bene il comportamento termico dei vetri soprattutto per quanto riguarda il fenomeno del rammollimento che avviene sempre entro un certo range di temperatura.
4.2.1) Regole di Zachariasen
Zachariasen propose un set di regole empiriche per prevedere la capacità di un ossido a formare strutture vetrose:
1) in un vetro un atomo di ossigeno deve al massimo essere legato a due atomi metallici
2) l’atomo metallico deve possedere un basso numero di coordinazione
3) i poliedri, componenti fondamentali del "network", devono condividere solo gli spigoli, è permessa una condivisione di un massimo di tre spigoli
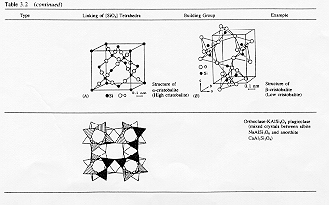
dalla analisi delle regole precedentemente esposte si possono fare alcune considerazioni: secondo questo modello ossidi del tipo M2O ed MO non possono formare vetri a causa dell’alto numero di coordinazione posseduto dall’atomo metallico (in genere 8 o 12), gli ossidi del tipo M2O3 non sono vetro-formatori a causa della tendenza degli atomi metallici alla coordinazione ottaedrica. Eccezioni sono rappresentate dal boro che avendo un orbitale di legame ibridato sp2 si coordina agli atomi di ossigeno in una simmetria ternaria e dall’alluminio solo quando si coordina in una simmetria tetraedrica; in certe condizioni anche l’alluminio che ha normalmente una coordinazione ottaedrica forma dei tetraedri del tipo [AlO4]- questo nei vetri avviene in particolare quando sono presenti quantità equimolari di metallo alcalino che inducono il passaggio di coordinazione da ottaedrica a tetraedrica e rendono l’alluminio un vetro-formatore (Fig.6)
Fig 6
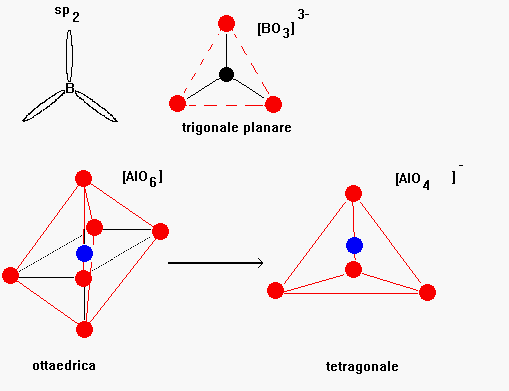
Ossidi del tipo MO2 M2O5 formano vetri solo quando assumono simmetria tetraedrica come nel caso della SiO2 del GeO2 del As2O5 mentre ossidi del tipo MO3 M2O7 MO4 possono formare vetri solo se danno origine ad una struttura formata da unità ottaedriche unite per i vertici
4.2.2) Miscele binarie
Introducendo in un ideale vetro di silice una certa percentuale di ossidi (nel caso specifico ossidi di metalli alcalini ed alcalino-terrosi) § 2.7 § 2.7 b il modello prevede la rottura dei ponti ad ossigeno del network con l’introduzione dei grossi cationi tipo Na+ K+ Ca++ Ba++ nelle cavità originatesi.
§
2.7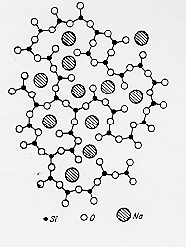
§
2.7 b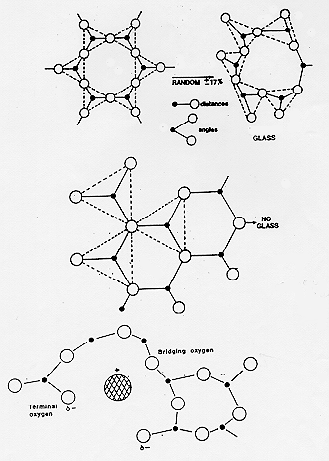
4.2.3) Classificazione degli ossidi
In base a questo modello si possono classificare gli ossidi in:
1) Ossidi formatori di reticolo :aventi n° di coordinazione 3,4 (Es. Si, B, P, Ge,As...)
2) Ossidi modificatori di reticolo :aventi n° di coordinazione ³ 6 (Es. Na, K, Li...)
3) Ossidi intermedi o stabilizzatori :non possono formare un vetro da soli ma hanno la capacità di stabilizzare la struttura vetrosa agendo ora da formatori di reticolo (n° coordinazione 4) ora da modificatori (n° coordinazione 6,8)
4.2.4) Verifiche sperimentali
La teoria del network continuo di Zachariasen Warren ha trovato numerose conferme sperimentali: nei vetri binari alcalino-silicatici all’aumentare della percentuale molare di ossido alcalino M2O si è verificata una riduzione della viscosità h in accordo con la progressiva rottura dei ponti ad ossigeno e quindi dell’indebolimento della struttura, analogamente si è osservato un aumento della conducibilità elettrica dovuto ad un aumento della mobilità ionica (ioni M+ legati ad atomi ad ossigeno mediate legame fortemente polarizzati) ed un aumento del coefficiente di dilatazione lineare a dovuto al progressivo aprirsi della struttura del network continuo.
4.2.5) Anomalie
Sperimentalmente si sono riscontrate delle anomalie alla teoria standard nel valore dell’energia dello scorrimento viscoso in funzione della percentuale molare di ossido alcalino aggiunto: supponiamo di avere un vetro di silice pura e di calcolare E per progressive aggiunte di ossido di sodio (Fig. 7)
Fig 7
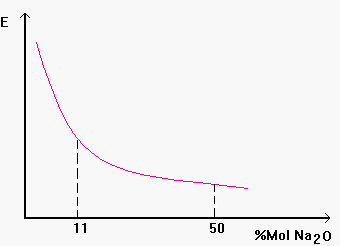
Per aggiunta dell’ossido vetro-modificatore ad un ideale vetro di silice pura si nota un comportamento non lineare dell’energia di attivazione dello scorrimento viscoso: per aggiunte fino al 11% molare l’energia si abbassa in accordo al modello di Zachariasen tuttavia al di sopra di questo valore e fino al 50 % mol di Na2O l’energia decresce molto meno di quanto dovrebbe.
4.3) Teoria di Dietzel
E’ una estensione del modello di Zachariasen alle considerazioni di Goldschmidt, Dietzel fece il tentativo di quantificare l’influenza delle forze interattive tra cationi ed anioni in gioco durante la solidificazione di un fuso in un vetro. Dalla relazione tra due cariche elettriche Q ad una distanza a la forza di interazione P è data da:
![]()
nel caso dell’interazione catione-anione la forza interagente K sarà:
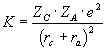
dove Z è la valenza dello ione, e la carica dell’elettrone ed r il raggio ionico. Dietzel semplificò questa espressione introducendo la forza di campo F:
![]()
dove a è il raggio del catione, con F si quantifica l’effetto del catione assumendo che l’anione sia sempre l’ossigeno.
Dalla tabella § 2.8 si vede come la classificazione empirica di Zachariasen degli ossidi possa essere messa in relazione con la forza di campo inoltre si riescono a spiegare fenomeni anomali dello stato vetroso quali la smiscelazione di due fasi vetrose o la cristallizzazione di un vetro.
§
2.8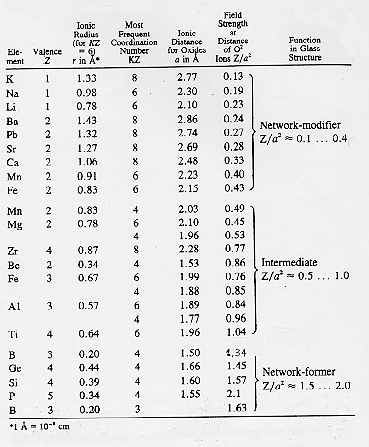
4.3.1) Effetto della forza di campo sulle miscele binarie di ossidi
la valutazione della differenza della forza di campo è utile per interpretare il comportamento di sistemi semplici (binari) composti da un ossido formatore di reticolo(SiO2) e un ossido diverso.
1) Caso 0£ D F£ 0,2
raffreddando un fuso binario di silice e di un ossido formatore di reticolo tale che la differenza nella forza di campo sia bassa si osserva che i due cationi tendono entrambi a coordinare ossigeni ed a formare strutture tipo network continuo: in genere il risultato è una immiscibilità tra due fasi liquide che porta alla formazione di fasi vetrose composte da ossidi puri.
Il diagramma di fase SiO2-B2O3 (D F =0,06) presenta delle regioni di immiscibilità (SiO2:B2O3 60:40) nelle quali si sono osservate due fasi vetrose compresenti.
2) Caso 0,3£ D F£ 1,33
In questo caso il catione con forza di campo maggiore (il silicio) riuscirà a raggiungere la coordinazione ottimale per la formazione di un a fase vetrosa mentre il catione con forza di campo un po’ più bassa coordinerà gli ossigeni già legati al silicio: in questo caso si possono formare composti binari e il fuso può subire processi di cristallizzazione durante il raffreddamento.
Il sistema SiO2-P2O5 (D F=0,53) presenta fenomeni di devetrificazione in raffreddamento (vetro opaline). Una D F abbastanza piccola è responsabile anche della devetrificazione dei sistemi vetro-ceramici: Zr Ti aggiunti come catalizzatori: in genere tendono a cristallizzare come composti binari e formare nuclei di cristallizzazione ad esempio nella devetrificazione del diopside nel sistema (Ca Mg Si) o della cordierite nel sistema ( Ca Al Si)
3) Caso D F³ 1,33
la differenza della forza di campo tra silicio e catione ospite è talmente elevata che non c’è più competizione con il silicio vetro-formatore in questo caso aumenta la probabilità di formazione di una fase vetrosa in raffreddamento: è il caso di miscele binarie di silice con ossidi vetro-modificatori: in genere i fusi raffreddati danno origine a vetri.
4.4) Teoria di Lebedev-Porai-Koshits
La scuola russa di Lebedev sviluppò negli anni trenta di questo secolo una teoria parallela a quella di Zachariasen ipotizzando la struttura del vetro come un aggregato di entità microcristalline che si strutturano in modo continuo e senza limiti come in un mosaico § 2.9 queste entità non visibili ad occhio nudo né con l’ausilio di microscopi ottici furono chiamate cristalliti .
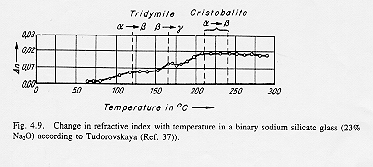
Il modello di Lebedev spiega alcune proprietà non lineari dello stato vetroso come ad esempio la variazione dell’indice di rifrazione di un vetro sodio-silicatico: essa viene compresa in termini di trasformazioni delle fasi cristalline tridimite a® b® g e cristobalite a® b
§
2.9
Porai e Koshits modificarono la teoria di Lebedev in seguito a studi di diffrazione a raggi X effettuati su vetri: essi stabilirono che
a) i vetri tendono a devetrificare gradualmente da determinati siti di cristallizzazione: in questo processo non viene quindi coinvolta l’intero volume del vetro come previsto da Zachariasen ma anche nel modello di Lebedev
§
2.9b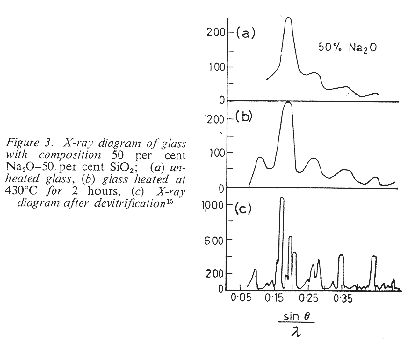
Il vetro quindi secondo Porai e Koshits è formato da "isole cristalline" del tipo ![]() fortemente ordinate all’interno e collegate tra di loro da una struttura più disordinata
fortemente ordinate all’interno e collegate tra di loro da una struttura più disordinata
4.5) Modello Huggin-Sun-Silvermann
Si suppose l’esistenza nei vetri silicatici di strutture tipo catene e anelli di gruppi tetraedrici SiO4 presenti in determinati range composizionali in analogia con quanto accade per i silicati complessi tipo le miche o i fillosilicati.
4.6) Modello di Van Wazer dei vetri fosfatici
applicabile a range composizionali tra il 50 ed il 70% mol di MxO si suppone la struttura del vetro composta da piccoli anelli e catene di lunghezza variabile.
4.7) Teoria di Bockris o degli "ioni discreti"
Bokris ed al. ipotizzano nella struttura del vetro la presenza di specie chimiche ben definite o "clusters" del tipo ![]() e
e ![]() in questo modo sui riesce a spiegare l’andamento non lineare di alcune proprietà dei vetri come ad esempio l’energia di scorrimento viscoso che abbiamo già incontrato (vedi Fig. 7). Nel vetro sodio-silicatico dell’esempio fino ad una aggiunta di Na2O del 11% mol. si ha un vistoso abbassamento dell’energia di scorrimento in accordo alla teoria di Zachariasen, tuttavia oltre questo valore si ha la formazione di gruppi discreti del tipo
in questo modo sui riesce a spiegare l’andamento non lineare di alcune proprietà dei vetri come ad esempio l’energia di scorrimento viscoso che abbiamo già incontrato (vedi Fig. 7). Nel vetro sodio-silicatico dell’esempio fino ad una aggiunta di Na2O del 11% mol. si ha un vistoso abbassamento dell’energia di scorrimento in accordo alla teoria di Zachariasen, tuttavia oltre questo valore si ha la formazione di gruppi discreti del tipo ![]() che si oppongono alla distruzione del network e quindi fanno abbassare meno rapidamente l’energia di scorrimento. In figura § 2.10 è riportata una sintesi delle teorie dello stato vetroso e dei campi composizionali a cui tali modelli si possono applicare da questa si può notare come siamo ancora lontani, per lo stato vetroso da una teoria unitaria ed esaustiva di tutti i fenomeni che lo caratterizzano.
che si oppongono alla distruzione del network e quindi fanno abbassare meno rapidamente l’energia di scorrimento. In figura § 2.10 è riportata una sintesi delle teorie dello stato vetroso e dei campi composizionali a cui tali modelli si possono applicare da questa si può notare come siamo ancora lontani, per lo stato vetroso da una teoria unitaria ed esaustiva di tutti i fenomeni che lo caratterizzano.
§
2.10